L’étude est réalisée dans 109 hôpitaux et supervisée par dix sociétés professionnelles japonaises, dont la Japanese Circulation Society
TOKYO–(BUSINESS WIRE)–Une étude prospective de trois ans menée par des chercheurs évalue des patients japonais traités par une pompe cardiaque Impella démontre que l’utilisation d’Impella est associée à un taux de survie de 77 % à 30 jours chez des patients IAM en état de choc cardiogénique. Le taux de survie historique pour les choc cardiogénique est d’environ 50 %. Supervisée par dix sociétés professionnelles japonaises, dont la Japanese Circulation Society (JCS), l’étude est la première à utiliser le registre japonais des dispositifs d’assistance ventriculaire percutanée (J-PVAD) pour évaluer l’efficacité et l’innocuité d’Impella. Les données du J-PVAD sont contrôlées et partagées de manière indépendante avec l’Agence japonaise des dispositifs pharmaceutiques et médicaux (PMDA). Yoshiki Sawa, D.M., Ph.D., chercheur principal de l’étude, a présenté aujourd’hui l’analyse intermédiaire en tant qu’étude clinique de dernière minute lors du Congrès scientifique annuel de la JCS.
L’analyse intermédiaire a examiné 819 patients traités par Impella pour un éventail de conditions, dont le choc cardiogénique et la myocardite fulminante, dans 109 hôpitaux japonais. D’autres résultats démontrent que la thérapie par Impella est un traitement hautement efficace pour la myocardite fulminante, avec un taux de survie de 88 % à 30 jours. Globalement, les chercheurs ont conclu que les données de survie à 30 jours indiquent qu’Impella est une thérapie bénéfique.
« Ces données démontrent que l’utilisation précoce d’Impella chez des patients atteints d’une insuffisance cardiaque aiguë résistante aux médicaments peut régulièrement atteindre des taux élevés de survie et de récupération du cœur natif pour les patients atteints de choc cardiogénique et d’autres conditions graves et potentiellement mortelles », déclare Dr Sawa, professeur du service de chirurgie cardiovasculaire de l’école de médecine de l’université d’Osaka et président de l’Association japonaise de chirurgie thoracique. « Une telle performance a été atteinte grâce à l’adoption des meilleures pratiques pour l’utilisation d’Impella. Je remercie mes collègues de la communauté clinique japonaise pour avoir suivi les protocoles et les directives du comité d’Impella dans l’optique de proposer une nouvelle thérapie bénéfique pour nos patients. »
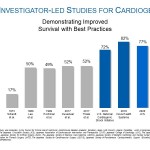
Une précédente analyse des taux de survie pour les chocs cardiogéniques au Japon par Ueki et al. (Circulation, 2015), a démontré un taux de survie de 32 % à 30 jours chez des patients ayant reçu une oxygénation extracorporelle par membrane par voie veineuse/artérielle (V-A ECMO). Les taux de survie comparativement élevés avec Impella ont été atteints en suivant les meilleures pratiques établies, qui consistent à placer la pompe Impella pré-ICP, identifier un choc cardiogénique de manière précoce, utiliser le bon cathéter cardiaque, et réduire l’utilisation d’inotropes. Les résultats de l’étude par rapport à l’utilisation des meilleures pratiques sont cohérents avec d’autres publications d’études menées par des chercheurs, comme l’étude National Cardiogenic Shock Initiative (NCSI) et l’étude Inova par Tehrani et al., qui ont démontré des augmentations significatives en termes de survie avec les protocoles de meilleures pratiques d’Impella (figure 1).
« Cette étude prometteuse démontre que lorsque les meilleures pratiques sont respectées des améliorations significatives peuvent être obtenues au niveau des taux de survie après un choc cardiogénique grâce à la pompe Impella », déclare William O’Neill, D.M., directeur médical du Centre sur les maladies cardiaques structurelles de l’hôpital Henry Ford Hospital, et chercheur principal de l’étude NCSI. « J’encourage les médecins du monde entier à prendre en considération les données en provenance du Japon, qui démontrent la logique derrière l’utilisation précoce d’Impella chez des patients atteints d’un choc cardiogénique. »
Dans une vidéo en ligne, le Dr Sawa et Chuck Simonton, D.M., responsable médical d’Abiomed, expliquent comment l’utilisation d’Impella et l’adoption des meilleures pratiques ont aidé les médecins japonais à atteindre des taux de survie élevés. La vidéo est disponible en cliquant ici.
Le rétablissement du cœur natif avec Impella est une thérapie rentable revêtant une importance particulière au Japon, un pays disposant d’un nombre limité de greffes cardiaques. L’étude du registre J-PVAD est supervisée par le Conseil d’utilisation clinique des sociétés universitaires liées aux dispositifs d’assistance ventriculaire (Japan VAD Council) et le comité d’Impella, qui comprend les dix organisations suivantes :
- Japanese Circulation Society (JCS)
- Japanese Association of Cardiovascular Intervention and Therapeutics (CVIT)
- Japanese College of Cardiology (JCC)
- The Japanese Heart Failure Society (JHFS)
- Japanese Society for Artificial Organs (JSAO)
- The Japanese Society of Intensive Care Medicine (JSICM)
- Japanese Society of Pediatric Cardiology and Cardiac Surgery (JSPCCS)
- The Japanese Association for Thoracic Surgery (JATS)
- The Japanese Society for Cardiovascular Surgery (JSCVS)
- Japanese Society of Percutaneous Cardiopulmonary Support / Extracorporeal Membrane Oxygenation (PCPS/ECMO)
Fabriquée par Abiomed (NASDAQ: ABMD), la pompe cardiaque Impella est le dispositif d’assistance circulatoire mécanique le plus étudié de l’histoire de la FDA, avec plus de 14 années d’études réalisées par la FDA, des données cliniques inégalées portant sur plus de 125 000 patients, et plus de 650 publications évaluées par un comité de lecture.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® bénéficient d’une approbation avant commercialisation de la FDA américaine pour le traitement de certains patients atteints d’insuffisance cardiaque avancée qui subissent des interventions coronaires percutanées (ICP) électives et urgentes, telles que l’angioplastie par pose de stent ou de ballonnet, afin de rouvrir les artères coronaires obstruées. Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5® avec SmartAssist® sont des pompes cardiaques approuvées par la FDA américaine, utilisées pour traiter les patients subissant des crises cardiaques ou atteints de cardiomyopathie en état de choc cardiogénique. Elles possèdent la capacité unique de permettre la récupération de la fonction cardiaque native, permettant ainsi aux patients de rentrer chez eux sans être greffés. Le dispositif Impella RP® est approuvé par la FDA américaine pour traiter l’insuffisance ventriculaire droite ou une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque ou une opération à cœur ouvert. L’utilisation en urgence de la pompe Impella RP par du personnel soignant en milieu hospitalier est également permise afin de fournir une assistance ventriculaire droite temporaire pour une période allant jusqu’à 14 jours chez des patients en soins intensifs ayant une surface corporelle ≥ 1,5 m2, pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées à la Covid-19, y compris l’embolie pulmonaire. La pompe Impella RP n’a été ni autorisée ni approuvée pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées au Covid-19. L’utilisation de la pompe Impella RP a été autorisée par la FDA pour les cas d’urgence mentionnés ci-dessus, en vertu d’une autorisation d’utilisation d’urgence (EUA), et a été autorisée uniquement tant que la déclaration de l’existence de circonstances justifie l’autorisation d’utilisation d’urgence de dispositifs médicaux en vertu de la section 564(b)(1) de la loi, 21 U.S.C. § 360bbb-3(b)(1), à moins que l’autorisation ne soit résiliée ou révoquée plus tôt.
Au Japon, la pompe cardiaque Impella est utilisée pour l’indication suivante: dans le traitement d’une insuffisance cardiaque aiguë résistante aux médicaments attribuable à des causes comme le choc cardiogénique, un cathéter est inséré par voie percutanée/transvasculaire sans opération à cœur ouvert, et le sang est aspiré via la pointe d’un cathéter inséré/placé dans le ventricule gauche et pompé via l’orifice de sortie situé dans l’aorte ascendante, contribuant ainsi à la circulation sanguine antérograde dans le corps. L’objectif est d’améliorer l’hémodynamique et la récupération des muscles cardiaques grâce à une assistance rapide du flux sanguin antérograde mini-invasive, tout en réduisant la charge sur les muscles cardiaques, permettant ainsi une reprise rapide de la fonction cardiaque.
En Europe, les dispositifs Impella 2.5, Impella CP et Impella CP avec SmartAssist sont certifiés CE pour le traitement des patients ICP à risque élevé et des patients IAM en état de choc cardiogénique pendant un maximum de 5 jours. Les pompes Impella 5.0 et Impella LD sont certifiées CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 10 jours. La pompe Impella 5.5 avec SmartAssist est certifiée CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 30 jours. La pompe Impella RP est certifiée CE pour le traitement de l’insuffisance ventriculaire droite ou d’une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque, une opération à cœur ouvert ou une arythmie ventriculaire réfractaire. Pour en savoir plus sur le portefeuille de pompes cardiaques Impella, y compris leurs indications approuvées et les informations importantes en matière de sécurité et de risque associées à l’utilisation de ces dispositifs, rendez-vous sur www.impella.com.
À PROPOS D’ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc. est un fournisseur de premier plan de dispositifs médicaux offrant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en assurant le pompage du cœur. Pour plus d’informations, veuillez consulter : www.abiomed.com. AAbiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist et Impella Connect sont des marques déposées d’Abiomed, Inc., et sont enregistrées aux États-Unis ainsi que dans certains autres pays. Impella BTR, Impella ECP, CVAD Study et STEMI DTU Study sont des marques commerciales en instance d’Abiomed, Inc.
DÉCLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement de produits existants et de nouveaux produits d’Abiomed, l’évolution de l’entreprise en matière de croissance commerciale, les opportunités futures et les approbations réglementaires attendues. Les résultats réels de la société peuvent être sensiblement différents de ceux escomptés dans ces déclarations prospectives en raison d’un certain nombre de facteurs, notamment les incertitudes liées à la portée, l’ampleur et la durée de la pandémie de COVID-19, au développement, aux tests et aux approbations réglementaires connexes, comme le potentiel de pertes futures, une fabrication complexe, des exigences de qualité élevées, la dépendance à l’égard de sources d’approvisionnement limitées, la concurrence, les changements technologiques, la réglementation gouvernementale, les litiges, les besoins en capitaux dans le futur et l’incertitude quant à l’obtention de financements supplémentaires, ainsi que d’autres risques et difficultés détaillés dans les documents déposés par la société auprès de la Commission américaine des valeurs mobilières et boursières (SEC), notamment le dernier rapport annuel déposé sur formulaire 10-K ainsi que les documents déposés ou présentés par la suite auprès de la SEC. Le lecteur est prié de ne pas se fier indûment aux déclarations prospectives, qui sont valables uniquement à la date du présent communiqué. La société n’est aucunement tenue de publier les résultats d’une quelconque révision de ces déclarations prospectives qui pourrait être faite afin de refléter des événements ou des circonstances survenant après la date de publication de ce communiqué ou pour refléter la survenue d’événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Sarah Karr
Responsable de la communication
978-882-8211
skarr@abiomed.com