- L’étude de maintenance de Phase 2a avec ABX464 dans la rectocolite hémorragique a démontré une excellente efficacité à long terme ainsi qu’une bonne tolérance
- L’étude de Phase 2b avec ABX464 dans la rectocolite hémorragique progresse dans 15 pays européens et au Canada, le recrutement des patients se déroule comme prévu
- Approbation par la FDA d’une demande d’IND pour l’étude clinique de Phase 2b avec ABX464 dans la rectocolite hémorragique, le recrutement des premiers patients aux États-Unis est attendu pour le deuxième trimestre 2020
- L’étude de Phase 2a avec ABX464 dans la polyarthrite rhumatoïde progresse comme prévu
- Premier patient récemment inclus dans l’étude de Phase 1/2 aux États-Unis avec ABX196 dans le traitement du carcinome hépatocellulaire
- Trésorerie finançant les activités opérationnelles jusqu’à la fin du deuxième trimestre 2020
PARIS–(BUSINESS WIRE)–Regulatory News :
Abivax SA (Paris:ABVX) (Euronext Paris : FR0012333284 – ABVX), société de biotechnologie au stade clinique qui mobilise le système immunitaire afin de développer de nouveaux traitements contre les maladies inflammatoires, le cancer et les maladies virales, a publié aujourd’hui ses résultats financiers de l’exercice 2019 clos le 31 décembre, et présenté ses avancées sur ses différents produits et essais cliniques en cours. Les comptes annuels 2019 ont été audités et approuvés par le Conseil d’Administration le 10 mars dernier. Le rapport de certification par les commissaires aux comptes externes est en cours d’émission.
Le Professeur Hartmut J. Ehrlich, M.D., Directeur Général d’Abivax, déclare : « Abivax a franchi plusieurs étapes cliniques et réglementaires clés en 2019 et au début 2020, traduisant une année particulièrement réussie dans la mise en œuvre de notre stratégie de développement à long terme. L’efficacité d’ABX464 dans la RCH a démontré un potentiel transformatif, et notre candidat médicament phare a fait des progrès cliniques significatifs. ABX464 se situe désormais à mi-parcours de son développement clinique, en Europe ainsi qu’au Canada, et l’approbation récente par la FDA d’une demande d’IND nous permet d’inclure des patients aux États-Unis. Il est également important de souligner que nous avons pu étendre notre portefeuille de produits en phase clinique avec ABX196, désormais testé dans le traitement du cancer du foie aux États-Unis. Nous travaillons actuellement à créer de la valeur et à obtenir le meilleur résultat pour nos actionnaires, en accélérant nos programmes de développement en cours et en accroissant nos ressources de financement. Conclure un partenariat demeure notre scénario privilégié. »
Didier Blondel, Directeur Financier d’Abivax, ajoute : « Avant même la régression récente du cours de l’action Abivax du fait de Covid-19, nous étions convaincus que la valorisation d’Abivax ne reflétait pas le potentiel de blockbuster d’ABX464, tant en matière de ventes que de profitabilité. En effet, l’ABX464 pourrait potentiellement être efficace dans diverses indications dans le domaine des maladies inflammatoires, et donc viser simultanément des marchés importants dont les besoins médicaux restent insatisfaits. Avec notre trésorerie disponible, incluant une position de trésorerie de 9,8 millions d’euros à fin 2019, nos activités opérationnelles seront financées jusqu’au deuxième trimestre 2020. Grâce aux financements déjà réalisés et au soutien continu de nos investisseurs, nous sommes dans une position solide pour orienter nos options stratégiques en direction de l’amélioration de la valeur actionnariale. »
En ce qui concerne le développement actuel autour du COVID-19, Abivax prend les mesures nécessaires pour limiter l’impact sur ses études cliniques en cours et pour assurer l’accès des patients à ABX464 et ABX196. Abivax pilote de près la situation et communiquera tous les changements significatifs potentiels de manière appropriée.
Principaux éléments financiers pour l’exercice
|
Eléments du compte de résultats |
|
2019 |
2018 |
|
Variation |
|
en millions d’euros |
|
|
|
|
|
|
Total produits d’exploitation |
0,0 |
0,8 |
(0,8) |
||
|
Total charges d’exploitation |
(33,3) |
(19,9) |
(13,4) |
||
|
dont frais de Recherche et Développement |
(29,0) |
(15,9) |
(13,1) |
||
|
dont frais administratifs et généraux |
(4,3) |
(4,0) |
(0,3) |
||
|
Résultat d’exploitation |
|
(33,3) |
(19,1) |
|
(14,2) |
|
Résultat financier |
(1,7) |
(0,5) |
(1,2) |
||
|
Résultat courant |
|
(35,0) |
(19,6) |
|
(15,4) |
|
Résultat exceptionnel |
0,1 |
0,0 |
0,1 |
||
|
Impôt sur les bénéfices |
4,2 |
3,8 |
0,4 |
||
|
Résultat de l’exercice |
|
(30,6) |
(15,8) |
|
(14,8) |
|
Eléments du bilan financier |
|
31/12/2019 |
31/12/2018 |
|
Variation |
|
en millions d’euros |
|
|
|
|
|
|
|
|
|
|||
|
Position financière nette |
|
(11,0) |
2,1 |
|
(13,1) |
|
dont immobilisations financières* |
0,0 |
5,0 |
(5,0) |
||
|
dont dépôts à terme (échéance > 1 an) |
0,0 |
0,0 |
0,0 |
||
|
dont dépôts à terme (échéance < 1 an) |
0,0 |
5,0 |
(5,0) |
||
|
dont trésorerie disponible |
9,8 |
8,0 |
1,8 |
||
|
(dont dettes financières) |
(20,7) |
(10,9) |
(9,8) |
||
|
Total de l’actif |
|
51,7 |
54,0 |
|
(2,3) |
|
|
|
|
|||
|
Total des fonds propres |
|
18,6 |
34,7 |
|
(16,1) |
|
dont capitaux propres |
11,8 |
28,7 |
(17,0) |
||
|
dont avancées conditionnées |
|
6,8 |
5,9 |
|
0,9 |
|
* A l’exception des éléments du contrat de liquidité (liquidités et actions propres) et les dépôts & garanties |
|||||
- En 2019, le résultat opérationnel est de -33,3 millions d’euros (-14,2 millions d’euros par rapport aux -19,1 millions d’euros constatés au 31 décembre 2018), Il reflète principalement l’augmentation des investissements en R&D (13,1 millions d’euros).
- Au 31 décembre 2019, le nombre total d’employés était stabilisé à 26.
- Les dépenses de R&D s’élèvent à 29 millions d’euros principalement en raison du besoin de financement des coûts de développement d’ABX464 dans des indications inflammatoires (81% du total des dépenses en R&D), ainsi que de l’investissement dans la plateforme de recherche sur l’épissage des ARN et le développement de la chimiothèque de petites molécules (12%).
- Les frais généraux et administratifs s’élèvent à 4,3 millions d’euros en 2019 (13% du total des charges d’exploitation) contre 4 millions d’euros (20%) en 2018.
- Les crédits d’impôts, majoritairement constitués par le Crédit d’Impôt Recherche, s’élèvent à 4,2 millions d’euros en 2019, contre 3,8 millions d’euros en 2018.
- La consommation de trésorerie s’élève à 2,7 millions d’euros par mois en 2019 ; Abivax a tiré la deuxième tranche d’un montant de 10 millions d’euros de l’accord de prêt Kreos Capital en mai 2019 et a réalisé une augmentation de capital de 12 millions d’euros souscrite par Sofinnova en juillet 2019, permettant une diminution limitée de la trésorerie de -3,2 millions d’euros en 2019 ; la trésorerie fin 2019 s’élève à 9,8 millions d’euros contre 13 millions d’euros fin 2018.
-
La Société est entièrement financée jusqu’au deuxième trimestre 2020, sur la base des hypothèses suivantes :
- la planification des besoins R&D ;
- l’exercice du solde de la ligne de financement en fonds propres avec Kepler Cheuvreux pour 7 millions d’euros (hypothèse de cours à 12 €) ;
- les versements à venir du Crédit d’Impôt Recherche 2019 représentant 4 millions d’euros.
Faits marquants : Mise à jour du portefeuille produits
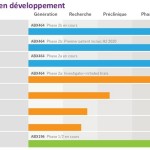
ABX464 dans la rectocolite hémorragique (RCH)
Suite aux résultats prometteurs de l’étude d’induction de la Phase 2a, Abivax a présenté des données générées pendant l’étude de maintenance en ouvert sur 12 mois. Les observations de cette étude confirment les bons résultats préliminaires sur la tolérance d’ABX464 ainsi que les premières preuves de son excellente efficacité à long terme. Par ailleurs, les données montrent également qu’ABX464 a maintenu la surexpression de miR-124 (microARN jouant un rôle essentiel dans l’immunité et l’inflammation modulée par ABX464), tout au long des 12 mois de l’étude.
Basé sur les résultats encourageants des études d’induction et de maintenance de Phase 2a, Abivax a initié une étude de Phase 2b, ABX464-103, dans la RCH dans laquelle le premier patient a été traité en août 2019. L’entreprise mène également une étude de maintenance en ouvert, ABX464-104, chez les patients qui ont terminé l’étude ABX464-103 pour confirmer la tolérance et l’efficacité d’ABX464 à long terme. L’étude d’induction de Phase 2b dans la RCH est actuellement menée sur 232 patients dans 126 centres d’étude situés dans 15 pays européens, au Canada et, plus récemment, aux États-Unis après l’approbation d’une demande d’IND par la FDA en janvier 2020. Les premiers résultats de l’essai sont attendus au dernier trimestre 2020.
À ce jour, plus de 210 patients ont été traités avec ABX464, y compris ceux qui le prennent quotidiennement depuis deux ans sans interruption. En comparaison avec les options thérapeutiques actuellement disponibles dans la RCH, l’ABX464 démontre un très bon profil de tolérance, ainsi qu’une efficacité soutenue à long terme.
ABX464 dans la polyarthrite rhumatoïde (PR)
ABX464-301 est une étude de Phase 2a visant à évaluer la tolérance et l’efficacité préalable de deux doses orales d’ABX464 administrées quotidiennement en association avec le méthotrexate (MTX), chez des patients atteints de polyarthrite rhumatoïde (PR) active modérée à sévère et présentant une réponse inadéquate au MTX et/ou à un ou plusieurs Facteurs de Nécrose Tumorale alpha (TNFα). Le critère d’évaluation principal de l’étude sera son profil de tolérance. L’essai est mené dans 24 centres d’étude sur un nombre maximal de 60 patients à travers l’Europe, y compris la Belgique, la République tchèque, la France, la Hongrie et la Pologne. Les premiers résultats de l’étude d’induction après trois mois sont attendus au cours de l’été 2020.
Les patients ayant achevé l’étude ABX464-301 ont ensuite la possibilité de continuer le traitement dans une étude de maintenance de Phase 2a en ouvert, ABX464-302, pour évaluer la tolérance et l’efficacité d’ABX464 sur 12 mois dans la PR.
ABX464 dans la maladie de Crohn
Basé sur les similitudes cliniques entre la maladie de Crohn et la RCH et sur la prévisibilité du modèle DSS pour la RCH et la maladie de Crohn, plusieurs experts reconnus (KOL) sont confiants qu’ABX464 aura également un effet bénéfique chez les patients souffrant de la maladie de Crohn. Fondé sur le bon profil de tolérance et les résultats d’efficacité prometteurs d’ABX464 obtenus dans la RCH, Abivax a été encouragé par les KOLs à lancer un essai clinique de Phase 2b pour le traitement de la maladie de Crohn. Pour cet essai, l’inclusion des premiers patients est actuellement prévue au deuxième semestre 2020.
Le potentiel de marché d’ABX464 dans les maladies inflammatoires
L’aire thérapeutique inflammatoire est concernée par des besoins médicaux hautement insatisfaits et conséquemment représente une opportunité de marché substantielle. En 2019, on estime à près de 1,7 millions le nombre de patients atteints de la RCH aux États-Unis, en G5 Europe (France, Allemagne, Italie, Espagne, Grande-Bretagne) et au Japon, dont la moitié souffre de la RCH modérée à sévère. Cela représente un potentiel de marché relatif à ces pays de 5,8 milliards de dollars par an, sur la base des estimations de ventes de produits pharmaceutiques en 2019 pour la RCH seule. Pour les Maladies Inflammatoires Chroniques de l’Intestin (MICI, comprenant notamment la RCH et la maladie de Crohn), les ventes atteignent 17,2 milliards de dollars en 2019. Le nombre de patients atteints de la polyarthrite rhumatoïde aux États-Unis, en G5 Europe et au Japon en 2019 est estimé à 4,4 millions de cas, représentant un potentiel de marché de 25 millions de dollars.
Le potentiel de marché pour l’ensemble des indications inflammatoires (y compris les maladies neuro-inflammatoires) est aujourd’hui estimé à plus de 80 millions de dollars, avec un marché et une population de patients qui, selon la Société, pourraient bénéficier d’ABX464.1
ABX196 pour le traitement du carcinome hépatocellulaire (CHC – cancer du foie)
Abivax mène actuellement un essai clinique de Phase 1/2 aux États-Unis chez des patients souffrant de carcinome hépatocellulaire (CHC) dans lequel ABX196 est évalué en association avec le nivolumab (Opdivo®, Bristol Myers Squibb), un inhibiteur de point de contrôle. L’étude est menée en collaboration avec le Scripps MD Anderson Cancer Center à San Diego et le MD Anderson Cancer Center à Houston, en outre, le premier patient a récemment été traité avec ABX196 et le nivolumab. Un nombre maximal de 46 patients seront inclus dans cette étude qui consiste en deux phases, une phase d’escalade de la dose et une phase d’extension. Les premiers résultats de la phase d’escalade de la dose sont attendus à la fin de cette année. Ces données fourniront des informations sur le niveau de dose efficace tout en étant bien tolérée par les patients.
Développement d’ABX464 dans le VIH
Abivax poursuit son plan de développement clinique d’ABX464 pour le VIH à travers des « investigator-initiated trials », c’est-à-dire des essais initiés et menés de manière indépendante par des centres d’études et pour lesquels Abivax fournit le médicament d’essai.
Nouvelles molécules antivirales dans le domaine des maladies infectieuses
Le criblage de la chimiothèque de petites molécules antivirales d’Abivax a mené à l’identification de composés potentiels visant le virus respiratoire syncytial (VRS), la grippe et la dengue. Dans le cadre de sa collaboration à long terme avec Evotec, un composé phare ciblant le VRS a été identifié et est récemment entré en phase de développement préclinique.
De plus, Abivax s’attend à ce que plusieurs de ses composés antiviraux soient testés contre le COVID-19.
Agenda financier
- Jeudi 30 avril 2020 : Publication du Rapport Financier Annuel 2019
- Vendredi 5 juin 2020 : Assemblée Générale annuelle
- Jeudi 24 septembre 2020 : Publication des résultats financiers au 30 juin 2020
- Mercredi 30 septembre 2020 : Publication du Rapport Financier Semestriel 2020
Événements à venir
- 2 – 5 mai 2020 : Digestive Disease Week – Chicago, États-Unis
À propos d’Abivax (www.abivax.com)
Entreprise de biotechnologie en phase clinique, Abivax mobilise le système immunitaire de l’organisme pour traiter les patients atteints de maladies auto-immunes, d’infections virales et de cancer. Abivax est cotée sur le compartiment B d’Euronext (ISIN : FR0012333284 – Mémo : ABVX). Pour plus d’informations sur la Société, visitez le site www.abivax.com/fr. Suivez-nous également sur Twitter @ABIVAX_.
AVERTISSEMENT
Le présent communiqué de presse contient des déclarations prospectives, des prévisions et des estimations relatives à certains programmes de la Société. Bien que la Société considère que ses déclarations prospectives, prévisions et estimations sont fondées sur des hypothèses et des évaluations des risques, incertitudes et autres facteurs connus et inconnus jugés raisonnables, ces déclarations prospectives, prévisions et estimations peuvent être remises en cause par un certain nombre d’aléas et d’incertitudes, de sorte que les résultats effectifs pourraient différer significativement de ceux anticipés dans lesdites déclarations prospectives, prévisions et estimations. Une description de ces risques, aléas et incertitudes figure dans les documents déposés par la Société auprès de l’Autorité des marchés financiers au titre de ses obligations réglementaires, à l’instar de son Document de référence. En outre, les présentes déclarations prospectives, prévisions et estimations ne sont valables qu’à la date du présent communiqué. Les lecteurs sont donc invités à ne pas s’y fier indûment. Abivax décline toute obligation d’actualisation de ces déclarations prospectives, prévisions ou estimations afin de refléter tout changement dont la Société aurait postérieurement connaissance, à l’exception de ce qui est requis par la législation. Ce communiqué de presse n’a qu’un but informatif, et les informations qui y sont contenues ne constituent pas une offre de vente ou la sollicitation d’une offre d’achat ou de souscription de titres de la Société dans toute juridiction, notamment en France. De même, il ne donne pas et ne doit pas être traité comme un conseil d’investissement. Il n’a pas non plus de lien avec les objectifs de placement, la situation financière ou les besoins particuliers de qui que ce soit. Il ne doit pas être considéré par quiconque comme un substitut à l’exercice de son propre jugement. Toutes les opinions exprimées dans ce document sont sujettes à changement sans préavis. La diffusion de ce communiqué de presse peut être restreinte par certaines législations locales. Les destinataires de ce communiqué de presse sont tenus de s’informer sur les éventuelles restrictions auxquelles ils pourraient être contraints et, le cas échéant, de les respecter.
1 Source : GlobalData
Contacts
Abivax
Finance
Didier Blondel
didier.blondel@abivax.com
+33 1 53 83 08 41
Press Relations & Investors Europe
MC Services AG
Anne Hennecke
anne.hennecke@mc-services.eu
+49 211 529 252 22
Abivax
Communications
Regina Jehle
regina.jehle@abivax.com
+33 6 24 50 69 63
Public Relations France
Actifin
Ghislaine Gasparetto
ggasparetto@actifin.fr
+33 1 56 88 11 22
Investors
LifeSci Advisors
Chris Maggos
chris@lifesciadvisors.com
+41 79 367 6254
Public Relations USA
Rooney Partners LLC
Marion Janic
mjanic@rooneyco.com
+1 212 223 4017