DANSEURS, Massachusetts–(BUSINESS WIRE)–Deux études réalisées sur des patients ayant subi un choc cardiogénique (AMICS) ont révélé un taux de survie plus élevé lorsque l’Impella était placé avant l’ICP, par rapport à celui obtenu lorsque l’Impella était placé après l’ICP. Les résultats ont été présentés lors du TCT Connect, le 32e symposium scientifique annuel de la Cardiovascular Research Foundation.
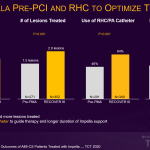
Au cours de la première étude, présentée par Hemindermeet Singh, DM, de l’Ascension St. John Hospital, les chercheurs ont évalué 649 patients répartis en deux cohortes : une cohorte récente (2017-2019) issue de l’étude d’homologation après la mise en marché (PMA) RECOVER III , après l’adoption généralisée de la meilleure pratique de placement de l’Impella avant l’ICP, et une pré-PMA (2008-2014), lorsque la pratique de placement de l’Impella avant l’ICP n’était pas encore largement adoptée. Les chercheurs ont observé un gain relatif de 18 % en termes de survie globale dans la cohorte récente, témoignant d’un avantage associé au placement de l’Impella avant l’ICP. La cohorte récente a également connu une incidence plus faible de lésions rénales aiguës (IRA) péri-ICP et de complications hémorragiques ou vasculaires majeures. Ceci en dépit d’une plus forte prévalence de l’hypertension, du tabagisme, des accidents vasculaires cérébraux et de l’insuffisance cardiaque de classe III/IV selon la New York Heart Association (NYHA) dans la cohorte récente. (voir figure 1)
« Ces données révèlent que l’adoption accrue des meilleures pratiques en matière de choc cardiogénique au cours des trois dernières années a conduit à une amélioration des taux de survie globaux », a déclaré Amir Kaki, DM, auteur principal de l’étude, cardiologue interventionnel et directeur du soutien circulatoire mécanique au Ascension St. John Hospital. « Si nous voulons améliorer les résultats pour nos patients, il est fondamental que les praticiens appliquent ces meilleures pratiques, qui comprennent l’identification précoce du choc, l’utilisation d’un cathéter cardiaque droit, la réduction des inotropes toxiques et l’utilisation de l’Impella avant l’ICP ».
« Notre étude témoigne de l’expérience croissante des médecins et des institutions. La mise en œuvre de protocoles standardisés de choc cardiogénique et l’utilisation accrue de stratégies visant à réduire les complications vasculaires et hémorragiques sont associées à une meilleure survie. Une compréhension approfondie de ces facteurs offre un potentiel considérable d’amélioration des résultats chez les patients ayant subi un choc cardiogénique dans la communauté en général », a déclaré le Dr Singh.
La deuxième étude, présentée par Tayyab Shah, DM, de la Yale School of Medicine, a analysé les données recueillies lors de l’essai RECOVER III entre 2017 et 2019. Elle a permis de constater que le fait de placer l’Impella avant l’ICP chez les patients atteints d’AMICS améliore le taux de survie par rapport au placement de l’Impella après l’ICP, en particulier chez les femmes. Les chercheurs de l’étude ont déterminé que les femmes avaient un avantage de 74 % en termes de survie relative avec l’utilisation de l’Impella avant l’ICP par rapport à l’ICP après. Les auteurs de l’étude concluent que l’implantation précoce de l’Impella procure un avantage significatif en termes de survie, en particulier chez les femmes. (voir figure 2)
« D’après cette étude, l’utilisation précoce du dispositif Impella pour aider les patients en état de choc cardiogénique, avant l’ICP et l’utilisation de médicaments inotropes/vasopresseurs, pourrait offrir un avantage en termes de survie, en particulier pour les femmes », a déclaré le Dr Shah. « Il s’agit d’un résultat intéressant d’une étude d’observation avec des implications cliniques significatives, qui doivent être explorées plus en détail au cours du prochain essai contrôlé randomisé RECOVER IV ».
Depuis l’approbation PMA par la FDA, Abiomed (NASDAQ : ABMD) a recueilli des données sur près de 100 % des patients américains Impella au sein de la base de données observationnelle Impella Quality (IQ). Ces données cliniques, combinées aux études post-approbation de la FDA, telles que RECOVER III, qui sont intégrées dans l’étude prospective d’Abiomed sur les dispositifs d’assistance ventriculaire (DAV) par cathéter et approuvées par un comité d’examen institutionnel, ont permis d’identifier et de valider les meilleures pratiques d’utilisation de l’Impella associées à une amélioration de la survie et à un rétablissement du cœur natif. Ces meilleures pratiques, y compris l’utilisation de l’Impella avant l’ICP, l’identification précoce du choc, la réduction des inotropes et la surveillance hémodynamique à l’aide de cathéters d’artère pulmonaire, sont maintenant validées par de nombreuses publications. (voir figure 3)
Par ailleurs, des études indépendantes menées par des médecins avec des protocoles de meilleures pratiques qui incluent le placement de l’Impella avant l’ICP, comme l’étude National Cardiogenic Shock Initiative (NCSI), l’étude Inova (Tehrani et al), et l’étude Japanese P-VAD (J-PVAD), ont démontré des augmentations significatives de la survie par rapport aux taux de survie historiques aux chocs cardiogéniques. (voir figure 4) Ces meilleures pratiques serviront de base au protocole d’étude pour le prochain essai contrôlé randomisé RECOVER IV d’Impella dans l’AMICS.
Afin de partager les meilleures pratiques en matière de traitement des chocs cardiogéniques, Abiomed organise un symposium au TCT Connect, le dimanche 18 octobre 2020 à 10h00 EDT, intitulé « Achieving >70% AMI-CS Survival: Best Practices from Around the World ». Le symposium est présidé par le docteur William O’Neill, directeur médical du Center for Structural Heart Disease du Henry Ford Hospital.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® bénéficient d’une approbation de pré-commercialisation de la FDA pour le traitement de certains patients atteints d’insuffisance cardiaque avancée qui subissent des interventions coronaires percutanées (ICP) planifiées ou urgentes, telles l’angioplastie par pose de stent ou de ballonnet, visant à rouvrir des artères coronaires obstruées. Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5® avec SmartAssist® sont des pompes cardiaques approuvées par la FDA utilisées pour traiter les patients subissant des crises cardiaques ou atteints de cardiomyopathie en état de choc cardiogénique. Elles possèdent la capacité unique de permettre la récupération de la fonction cardiaque native, permettant ainsi aux patients de rentrer chez eux sans être greffés. Le dispositif Impella RP® est approuvé par la FDA pour traiter l’insuffisance ventriculaire droite ou une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque ou une opération à cœur ouvert. L’utilisation en urgence de la pompe Impella RP par du personnel soignant en milieu hospitalier est également permise afin de fournir une assistance ventriculaire droite temporaire pour une période allant jusqu’à 14 jours chez des patients en soins intensifs ayant une surface corporelle ≥ 1,5 m2, pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées à la Covid-19, y compris l’embolie pulmonaire. La pompe Impella RP n’a été ni autorisée ni approuvée pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées à la Covid-19. Les systèmes d’assistance ventriculaire gauche (VG) Impella sont également autorisés pour une utilisation d’urgence par le personnel soignant en milieu hospitalier pour fournir une décharge et une assistance VG (≤ 4 jours pour Impella 2.5, Impella CP, et Impella CP avec SmartAssist; contre ≤ 14 jours pour Impella 5.0 et Impella 5.5 avec SmartAssist) dans le traitement de patients en soins intensifs atteints d’une infection à la COVID-19 confirmée suivant un traitement ECMO et ayant développé un œdème pulmonaire durant une assistance ECMO V-A ou une décompensation cardiaque tardive à la suite d’une myocardite durant une assistance ECMO V-V. Les systèmes d’assistance VG Impella n’ont été ni autorisés ni approuvés pour l’indication d’utilisation autorisée. L’utilisation de la pompe Impella RP et des Systèmes d’assistance VG Impella a été autorisée par la FDA pour les cas d’urgence mentionnés ci-dessus, en vertu d’une autorisation d’utilisation d’urgence (EUA), et a été autorisée uniquement tant que la déclaration de l’existence de circonstances justifie l’autorisation d’utilisation d’urgence de dispositifs médicaux en vertu de la section 564(b)(1) de la loi, 21 U.S.C. § 360bbb-3(b)(1), à moins que l’autorisation ne soit résiliée ou révoquée plus tôt.
En Europe, les dispositifs Impella 2.5, Impella CP et Impella CP avec SmartAssist sont certifiés CE pour le traitement des patients ICP à risque élevé et des patients IAM en état de choc cardiogénique pendant une durée maximale de 5 jours. Les pompes Impella 5.0 et Impella LD sont certifiées CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 10 jours. La pompe Impella 5.5 avec SmartAssist est certifiée CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant une durée maximale de 30 jours. La pompe Impella RP est certifiée CE pour le traitement de l’insuffisance ventriculaire droite ou d’une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque, une opération à cœur ouvert ou une arythmie ventriculaire réfractaire. Pour en savoir plus sur le portefeuille de pompes cardiaques Impella, y compris leurs indications approuvées et les informations importantes en matière de sécurité et de risque associées à l’utilisation de ces dispositifs, veuillez consulter www.impella.com.
À PROPOS D’ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc. est un chef de file des dispositifs médicaux offrant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en assurant le pompage du cœur. Pour plus d’informations, veuillez consulter www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella 5.5, Impella LD, Impella CP, Impella RP, SmartAssist et Impella Connect sont des marques déposées d’Abiomed, Inc., et sont enregistrées aux États-Unis ainsi que dans certains autres pays. Impella BTR, Impella ECP, CVAD Study et STEMI DTU Study sont des marques commerciales d’Abiomed, Inc. en cours de dépôt
DÉCLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement de produits existants et de nouveaux produits d’Abiomed, l’évolution de l’entreprise en matière de croissance commerciale, les opportunités futures et les approbations réglementaires attendues. Les résultats réels de la société peuvent être sensiblement différents de ceux escomptés dans ces déclarations prospectives en raison d’un certain nombre de facteurs, notamment les incertitudes liées à la portée, l’ampleur et la durée de la pandémie de la COVID-19, au développement, aux tests et aux approbations réglementaires connexes, comme le potentiel de pertes futures, une fabrication complexe, des exigences de qualité élevées, la dépendance à l’égard de sources d’approvisionnement limitées, la concurrence, les changements technologiques, la réglementation gouvernementale, les litiges, les besoins en capitaux à l’avenir et l’incertitude quant à l’obtention de financements supplémentaires, ainsi que d’autres risques et défis détaillés dans les documents déposés par la société auprès de la Commission américaine des valeurs mobilières et boursières (SEC), notamment le dernier rapport annuel déposé sur formulaire 10-K ainsi que les documents déposés ou présentés par la suite auprès de la SEC. Le lecteur est prié de ne pas se fier indûment aux déclarations prospectives, qui sont valables uniquement à la date du présent communiqué. La société n’est aucunement tenue de publier les résultats d’une quelconque révision de ces déclarations prospectives qui pourraient être faites afin de refléter des événements ou des circonstances survenant après la date de publication de ce communiqué ou pour refléter la survenue d’événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Tom Langford
Directeur de la communication
(978) 882-8408
TLangford@abiomed.com