PARIS–(BUSINESS WIRE)–Regulatory News:
GenSight Biologics (Paris:SIGHT) (Euronext : SIGHT, ISIN : FR0013183985, éligible PEA-PME), société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central, annonce aujourd’hui qu’une analyse statistique de données groupées provenant des études cliniques de LUMEVOQ® et d’études de l’histoire naturelle de la neuropathie optique héréditaire de Leber (NOHL) ont mis en évidence une différence statistiquement et cliniquement significative entre les résultats visuels des patients traités par LUMEVOQ® et ceux des patients non traités.
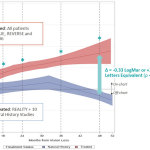
Une amélioration progressive et durable a été observée dans les yeux traités entre le Mois 12 et le Mois 52, alors qu’aucune amélioration n’a été constatée au cours de la même période dans les yeux non traités. Au Mois 18, la différence devenait statistiquement significative (p=0,01). Au Mois 48, la différence d’acuité visuelle moyenne entre les patients traités et les patients non traités était à la fois statistiquement significative (p<0,01) et cliniquement significative (0,33 LogMAR ou +16,5 lettres ETDRS, en faveur des yeux traités).
|
À noter : Tous les patients étaient porteurs d’une mutation G11778A confirmée du gène mitochondrial ND4, et étaient tous âgés de 15 ans minimum. Le graphique montre les courbes de lissage des nuages de points estimées localement (LOESS) de l’acuité visuelle des patients traités par LUMEVOQ® et des patients non traités. Les zones colorées représentent l’intervalle de confiance à 95% de l’acuité visuelle (BCVA) moyenne. Les données concernant les yeux ‘traités’ proviennent de tous les yeux (LUMEVOQ® et injection simulée) des études RESCUE, REVERSE et CLIN06 (N=76 patients / 152 yeux). Les données concernant les yeux ‘non traités’ proviennent des données des patients de l’étude REALITY et d’une série appariée de données issues de deux études prospectives et huit études rétrospectives sur l’histoire naturelle de la maladie 1 (N=208 patients / 408 yeux). Les courbes LOESS ont été estimées en utilisant un modèle de régression non paramétrique local où chaque œil est traité indépendamment de l’autre. Les courbes LOESS sont présentées à partir du Mois 12 pour illustrer l’évolution post-traitement chez les patients traités (93% des patients traités par LUMEVOQ® avaient déjà été traités dans les 12 mois suivant l’apparition de la perte de vision). *Différence statistiquement significative entre l’acuité visuelle moyenne des yeux traités et des yeux non traités à M18, M24, M36 et M48, comme illustré par le non-chevauchement des intervalles de confiance. |
L’analyse a comparé les données des études de Phase III terminées RESCUE et REVERSE et les résultats intermédiaires de l’étude de suivi à long terme CLIN06 à ceux d’un échantillon apparié provenant du registre REALITY et de 10 autres études sur l’histoire naturelle de la maladie1. Les études d’histoire naturelle ont été identifiées après une analyse approfondie de la littérature scientifique et sélectionnées quand elles incluaient les données individuelles des patients. Au total, les résultats visuels chez 76 patients traités ont pu être comparés aux résultats visuels de 208 patients non traités.
« La précision supplémentaire de cette analyse allant jusqu’aux données individuelles des patients confirme que le pronostic visuel chez les patients NOHL-ND4 non traités est mauvais, et offre la meilleure comparaison que nous ayons pour évaluer l’efficacité thérapeutique de la thérapie génique. » déclare le Dr. Nancy J. Newman, Professeur d’Ophtalmologie et de Neurologie LeoDelle Jolley, Emory University School of Medicine, Atlanta, Géorgie, Etats-Unis, et l’un des plus grands spécialistes de la NOHL, ayant récemment réalisé une méta-analyse de l’histoire naturelle de la NOHL-ND4. 2
Des analyses séparées des données des patients recrutés dans les études RESCUE et REVERSE ont mis en évidence des résultats positifs similaires comparé aux patients non traités. Les résultats complets de la comparaison indirecte ont été inclus dans la demande d’Autorisation de Mise sur le Marché (AMM) européenne pour LUMEVOQ®, et sont en cours de préparation pour une publication dans une revue scientifique à comité de lecture.
« Cette comparaison indirecte représente une contribution importante à notre compréhension de l’effet thérapeutique de LUMEVOQ®, » commente le Pr José-Alain Sahel, Directeur de l’Institut de la Vision (Sorbonne-Université/Inserm/CNRS), Paris; Chef du service d’Ophtalmologie, Centre Hospitalier National d’Ophtalmologie des Quinze-Vingts, Paris; Professeur et Chef du service d’Ophtalmologie, University of Pittsburgh School of Medicine et UPMC (University of Pittsburgh Medical Center); et Co-fondateur de GenSight Biologics. « Le recours à un large groupe contrôle externe, incluant les données individuelles des patients, apporte davantage de preuves d’une amélioration visuelle significative liée au traitement. »
« Ces observations sont le résultat gratifiant de nos efforts à surmonter un défi majeur dans l’évaluation de l’efficacité de LUMEVOQ®, à savoir l’incapacité des yeux non traités à servir de groupe contrôle, » commente Bernard Gilly, Co-Fondateur et Directeur Général de GenSight. « Nous sommes ravis de pouvoir apporter cette démonstration – que LUMEVOQ® modifie l’issue de la maladie – dans nos discussions avec les autorités nationales et régionales. »
La demande d’AMM Européenne de LUMEVOQ® a été déposée en septembre, et la décision est attendue pour le second semestre 2021. Par ailleurs, la Société prévoit également de soumettre un dossier de demande d’AMM aux Etats-Unis (BLA) pour LUMEVOQ® auprès de la FDA au second semestre 2021.
GenSight tiendra une conférence téléphonique aujourd’hui 21 septembre 2020 à 10h00 CEST en français, et à 14h00 CEST (8h00 EST) en anglais, pour discuter ces résultats.
Webcast & conférence téléphonique en français (10h00 CEST)
Numéros d’appel :
États-Unis : +1 212 999 6659
France : +33 (0)1 7037 7166
Royaume-Uni : +44 (0)20 3003 2666
Mot de passe : GenSight FR
Lien pour le Webcast : https://bit.ly/3mAS0Vy
Webcast & conférence téléphonique en anglais (14h00 CEST / 8h00 EST)
Numéros d’appel :
États-Unis : +1 212 999 6659
France : +33 (0) 1 7037 7166
Royaume-Uni : +44 (0) 20 3003 2666
Mot de passe : GenSight ENG
Lien pour le Webcast : https://bit.ly/35RCfnl
Pour réécouter les conférences téléphoniques et les webcasts, utiliser les liens ci-dessus.
Rationnel de la comparaison indirecte
Dans les études REVERSE et RESCUE, ainsi que dans l’étude de suivi à long terme CLIN06, les patients ayant reçu une injection unilatérale ont présenté une amélioration inattendue de l’acuité visuelle dans leur œil controlatéral, similaire à l’amélioration cliniquement significative et durable obtenue dans l’œil traité par LUMEVOQ®. Cette amélioration bilatérale a disqualifié le groupe contrôle qui, selon le protocole initial de l’étude, était constitué des yeux ayant reçu une injection simulée (sham). Par conséquent, une méthodologie par comparaison indirecte, basée sur des méthodes statistiques formelles appliquées à un groupe contrôle externe, était nécessaire pour évaluer le niveau d’efficacité de LUMEVOQ®.
Principales caractéristiques de la méthodologie
L’échantillon de données des patients traités par LUMEVOQ® regroupaient toutes les données des deux études pivots REVERSE et RESCUE, ainsi que les données de l’Année 3 de l’étude de suivi à long-terme en cours CLIN06. Cette approche a généré un groupe de 76 patients traités (152 yeux), composé des yeux traités par LUMEVOQ® et des yeux ayant reçu une injection simulée (sham), considérés comme équivalents en raison de l’effet controlatéral démontré dans les études.
Les données du groupe contrôle externe provenaient du registre d’histoire naturelle REALITY, et des données des patients décrites dans 10 articles publiés1 sur la NOHL-ND4, identifiés par une analyse systématique de la littérature. Les études sur la NOHL-ND4 n’ont été utilisées pour la comparaison indirecte que si elles fournissaient des données individuelles des patients permettant une comparaison indirecte aux données des patients traités par LUMEVOQ® : génotype ND4 confirmé, âge minimum de 15 ans, au moins une mesure de l’acuité visuelle associée au moment de la perte de vision. Le groupe contrôle final était composé de 208 patients (408 yeux).
Les courbes d’acuité visuelle des patients traités et non traités ont été définies à partir d’un modèle de régression non paramétrique local utilisant des courbes de lissage des nuages de points estimées localement (LOESS). Elles étaient alignées en termes de temps depuis l’apparition de la perte de vision pour les tests statistiques effectués aux M12, M18, M24, M36 et M48 depuis le début de la perte de vision et pour la dernière observation disponible. Le point de départ des tests statistiques (12 mois après la perte de vision) a été défini pour pouvoir évaluer l’efficacité de LUMEVOQ®, dans la mesure où 93% des patients LUMEVOQ® avaient été traités à cette date.
|
1Les 10 études répondant aux critères d’inclusion étaient : Hotta 1995, Lam 2014, Nakamura 1993, Newman 1991, Qu 2007, Qu 2009, Romero 2014, Sadun 2004, Yang 2016, et Zhou 2010. |
|
2 Newman NJ, Carelli V, Taiel M and Yu-Wai Man P. Visual outcomes in Leber hereditary optic neuropathy patients with the m.11778G>A (MTDN4) mitochondrial DNA mutation. J Neuro-Ophthalmol. En cours de publication. 2020. |
À propos de GenSight Biologics
GenSight Biologics S.A. (GenSight Biologics) est une société biopharmaceutique dédiée au développement et à la commercialisation de thérapies géniques innovantes pour le traitement des maladies neurodégénératives de la rétine et du système nerveux central. Le portefeuille de recherche de GenSight Biologics s’appuie sur deux plates-formes technologiques : le ciblage mitochondrial (Mitochondrial Targeting Sequence, ou MTS) et l’optogénétique, visant à préserver ou restaurer la vision chez les patients atteints de maladies neurodégénératives de la rétine. Le candidat médicament le plus avancé de GenSight Biologics, LUMEVOQ® (GS010 ; lenadogene nolparvovec), a fait l’objet d’un dépôt de demande d’AMM en Europe pour le traitement de la neuropathie optique héréditaire de Leber (NOHL), une maladie mitochondriale rare affectant principalement les adolescents et les jeunes adultes et conduisant à une perte irréversible de la vue. En utilisant son approche de thérapie génique, les candidats médicaments de GenSight Biologics sont destinés à offrir aux patients une récupération visuelle fonctionnelle durable après une seule injection intra-vitréenne dans chaque œil.
À propos de LUMEVOQ® (GS010)
LUMEVOQ® (GS010) cible la neuropathie optique héréditaire de Leber (NOHL), et s’appuie sur une technologie propriétaire de séquence de ciblage mitochondrial (MTS), issue des travaux de l’Institut de la Vision, qui, lorsqu’elle est associée au gène d’intérêt, permet de l’adresser spécifiquement à l’intérieur de la mitochondrie grâce à un vecteur AAV (Adeno-Associated Virus). Le gène d’intérêt est ainsi transféré dans la cellule pour y être exprimé et produire la protéine fonctionnelle, qui sera acheminée à l’intérieur des mitochondries grâce aux séquences nucléotidiques spécifiques, afin de restaurer la fonction mitochondriale déficiente ou manquante. « LUMEVOQ » a été autorisé comme nom commercial pour le GS010 (lenadogene nolparvovec) par l’Agence Européenne du Médicament (EMA) en octobre 2018.
À propos de la Neuropathie Optique Héréditaire de Leber (NOHL)
La neuropathie optique héréditaire de Leber (NOHL) est une maladie mitochondriale rare, de transmission maternelle, caractérisée par une dégénérescence des cellules ganglionnaires de la rétine et provoquant en moins d’un an une perte brutale et irréversible de la vision conduisant généralement à la cécité légale. Ces symptômes apparaissent principalement chez les adolescents et les jeunes adultes. La NOHL provoque une perte brutale, soudaine et sans douleur de la vision centrale dans le 1er œil, puis le 2nd œil est atteint à son tour, de manière irréversible. 97% des patients présentent une perte bilatérale de la vision en moins d’un an, et cette perte de vision est simultanée dans 25% des cas. La NOHL causerait la cécité visuelle chez environ 1 200 personnes par an aux Etats-Unis et en Europe.
À propos de RESCUE et REVERSE
RESCUE et REVERSE sont deux études distinctes de Phase III randomisées, en double masqué, contrôlées par injection simulée (sham), conçues pour évaluer l’efficacité d’une injection intravitréenne unique de GS010 (rAAV2/2-ND4) chez des sujets atteints de la NOHL induite par la mutation G11778A ND4.
Le critère d’évaluation principal mesure la différence d’efficacité de GS010 entre les yeux traités et les yeux non-traités (sham), sur la base de l’acuité visuelle (Best Corrected Visual Acuity ou BCVA), mesurée à l’aide de l’échelle ETDRS à 48 semaines après injection. Les scores « Logarithm of the Minimal Angle of Resolution » des patients, ou LogMAR, qui sont dérivés du nombre de lettres lues sur l’échelle ETDRS, sont utilisés à des fins statistiques. Les deux études ont été conçues pour évaluer une différence statistiquement significative d’au moins 15 lettres ETDRS entre les yeux traités et non-traités (sham), ajustés de l’acuité visuelle initiale (baseline).
Les critères d’évaluation secondaires incluent l’application de l’analyse principale aux yeux ayant reçu GS010 et présentant à l’inclusion la meilleure acuité visuelle initiale (« meilleur œil »), comparés à ceux ayant reçu la procédure sham, ainsi qu’aux yeux ayant reçu GS010 et présentant la moins bonne acuité visuelle initiale (« moins bon œil »), comparés à ceux ayant reçu la procédure sham. Également, une évaluation de la proportion de patients « répondeurs » est réalisée, incluant notamment le pourcentage de patients qui maintiennent leur acuité visuelle (perte de moins de 15 lettres ETDRS), le pourcentage de patients qui améliorent leur acuité visuelle de 15 lettres ETDRS ou plus, ainsi que le pourcentage de patients présentant une acuité visuelle finale >20/200, ou 1/10. Les paramètres visuels mesurés incluent également les champs visuels automatisés, la tomographie par cohérence optique, ainsi que la sensibilité aux couleurs et aux contrastes, en plus des mesures de qualité de vie, de bio-dissémination, et de réponse immunitaire post-injection.
Les études ont été menées en parallèle, chez 37 patients pour REVERSE et 39 patients pour RESCUE, dans 7 centres aux États-Unis, au Royaume-Uni, en France, en Allemagne et en Italie. Les résultats à 96 semaines de suivi des deux études ont été publiés en 2019. Les patients ont ensuite été transférés vers une étude de suivi à long terme pour 3 années supplémentaires.
Identifiants ClinicalTrials.gov :
REVERSE : NCT02652780
RESCUE : NCT02652767
À propos de CLIN06 (suivi à long terme des études RESCUE et REVERSE)
CLIN06 est une étude de suivi à long terme de sujets atteints de NOHL ND4 traités avec la thérapie génique LUMEVOQ® (GS010) dans le cadre des études cliniques de Phase III RESCUE ou REVERSE. La durée totale de l’étude de suivi est de 3 ans, soit 5 ans après l’injection. Aucun traitement de l’étude n’est administré pendant le suivi de CLIN06.
L’objectif principal est d’évaluer la sécurité à long terme d’une injection intravitréenne de LUMEVOQ® jusqu’à 5 ans après le traitement. L’objectif secondaire est d’évaluer l’efficacité à long terme du traitement ainsi que la qualité de vie des sujets pendant 5 ans après le traitement. Le premier sujet a été recruté le 9 janvier 2018, et 61 sujets ont été recrutés.
Identifiants ClinicalTrials.gov :
CLIN06 : NCT03406104
À propos de REALITY
REALITY est une étude observationnelle rétrospective et transversale internationale de sujets atteints de NOHL, basée sur les dossiers médicaux et l’administration d’enquêtes sur la qualité de vie liée à la santé (HRQoL), ainsi que les coûts directs et indirects associés à la maladie.
L’étude visait à recruter au moins 50 sujets (adultes et pédiatriques) principalement dans les pays suivants : Espagne, Italie, France, Royaume-Uni et États-Unis.
Les principaux objectifs de l’étude REALITY étaient les suivants : décrire l’évolution des changements fonctionnels et structurels visuels, ainsi que d’autres symptômes associés chez les patients atteints de NOHL ; comprendre l’impact de la perte de vision liée à la NOHL sur la HRQoL ; et comprendre les impacts économiques pour les patients et leurs familles découlant des coûts directs et indirects associés à la maladie. L’objectif secondaire est de décrire la relation entre les facteurs génétiques, de style de vie et / ou environnementaux et l’expression du phénotype NOHL.
Le premier sujet a été recruté le 3 janvier 2018, et le recrutement a pris fin au début du second trimestre 2020.
Identifiants ClinicalTrials.gov :
REALITY LHON Registry: NCT03295071
Contacts
GenSight Biologics
Directeur Administratif et Financier
Thomas Gidoin
tgidoin@gensight-biologics.com
+33 (0)1 76 21 72 20
LifeSci Advisors
Relations Investisseurs
Guillaume van Renterghem
gvanrenterghem@lifesciadvisors.com
+33 (0)6 69 99 37 83
NewCap
Relations Média
Annie-Florence Loyer
afloyer@newcap.fr
+33 (0)6 88 20 35 59
Orpheon Finance
Investisseurs Particuliers
James Palmer
j.palmer@orpheonfinance.com
+33 (0)7 60 92 77 74