DANVERS, Massachusetts–(BUSINESS WIRE)–Une étude portant sur 21 848 patients à risque élevé présentant des troubles non-émergents, qui ont subi une intervention coronarienne percutanée (ICP) à l’aide de dispositifs d’assistance ventriculaire (DAV) percutanés, dont Impella, démontre que les patients DAV présentaient un taux de mortalité et de complications inférieur à celui des patients ayant subi une ICP avec des pompes à ballonnet intra-aortique (PBIA). Cette étude d’Al-khadra, et al., a été publiée dans l’édition papier de la revue ‘Catheterization & Cardiovascular Interventions’ du 15 février 2020.
Dans l’analyse, la cohorte DAV était sensiblement plus malade que celle traitée via une PBIA. Plus âgés, les patients DAV présentaient des taux supérieurs d’hypertension, de diabète, d’hyperlipidémie, d’ICP antérieur, de pontage aorto-coronarien antérieur, d’anémie, de maladie pulmonaire chronique, de maladie hépatique, d’insuffisance rénale et de maladie vasculaire périphérique.
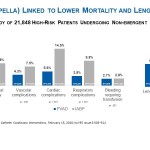
Comme précisé dans le schéma 1, en dépit de taux supérieurs de comorbidités, lorsque les chercheurs ont utilisé l’analyse de régression logistique multivariée (n=21 848) qu’ils avaient eux-mêmes établie, en comparaison avec les patients PBIA, les patients DAV étaient associés à:
- Un taux de mortalité hospitalière inférieur (6,1% contre 8,8%, p= <0,001)
- Un taux de complications vasculaires inférieur (4,3% contre 7,5%, p=0,046)
- Un taux de complications cardiaques inférieur (5,6% contre 14,5%, p= <0,001)
- Un taux de complications respiratoires inférieur (3,8% contre 9,8%, p= <0,001)
- Un taux de saignements similaire à celui des patients PBIA (2,7% contre 2,8%, p=0,581)
En outre, l’appariement des coefficients de propension (n=1 926) a démontré que, en comparaison avec les patients PBIA, les patients DAV présentaient:
- Un taux de mortalité hospitalière inférieur (3,5% contre 6,4%, p= <0,012)
- Un taux de complications vasculaires inférieur (3,4% contre 6,0%, p=0,017)
- Un taux de complications cardiaques inférieur (3,4% contre 12,2%, p= <0,001)
- Un taux de complications respiratoires inférieur (2,6% contre 6,1%, p=0,001)
- Un taux de saignements similaire à celui des patients PBIA (2,6% contre 2,4%, p=0,795)
Les chercheurs ont obtenu ces données auprès de la base de données National Inpatient Sampling (NIS), la plus vaste base de données de tous les soins des patients hospitalisés payeurs des Etats-Unis. La NIS, établie via un partenariat avec l’Agency for Healthcare Research and Quality (AHRQ), contient des données relatives à environ huit millions d’hospitalisations couvertes par l’assurance-maladie (Medicare) ou non. Ses auteurs ont divulgué et détaillé les méthodes d’étude de la population étudiée, des caractéristiques des patients et des hôpitaux, ainsi que de l’analyse statistique, y compris les modèles de régression linéaire et d’appariement des coefficients de propension.
« Cette analyse est un autre exemple de données réelles démontrant une amélioration des résultats chez les patients et une diminution de la durée de l’hospitalisation en cas d’utilisation d’un dispositif d’assistance ventriculaire, » a déclaré Perwaiz Meraj, MD, l’un des auteurs de l’étude, et directeur du Département de Cardiologie interventionnelle à la Zucker School of Medicine de Hofstra/Northwell, Northwell Health à Manhasset, dans l’Etat de New York. « L’utilisation des meilleures pratiques, techniques et technologies peut permettre d’obtenir une revascularisation plus sûre et plus complète qui améliore les résultats du patient ainsi que sa qualité de vie, » a-t-il ajouté.
La publication d’Al-khadra, et al. a également souligné le fait que les patients DAV bénéficiaient d’une hospitalisation plus brève que les patients PBIA (4 jours contre 5 jours p= <0,001). Cette conclusion est conforme à l'essai randomisé contrôlé PROTECT II (voir schéma 2) et à de nombreuses autres études révisées par des pairs, dont celle publiée par Maini, et al. dans la revue ‘Expert Review of Pharmacoeconomics & Outcomes Research’. Ayant évalué les constatations et conclusions de six publications, Maini et al. a conclu que les patients DAV, et plus particulièrement ceux traités via la pompe Impella 2.5, sont associés à une durée d’hospitalisation plus courte et une rentabilité réelle, en comparaison avec les patients PBIA.
« Les patients ICP à risque élevé constituent fréquemment un défi pour l’interventionniste, en raison des comorbidités du patient qui conduisent à des résultats moins bons, » a affirmé Cindy Grines, MD, l’une des auteurs de cette étude, cardiologue interventionnelle et directrice scientifique du Northside Hospital Cardiovascular Institute d’Atlanta. « Cette publication démontre le raisonnement à l’origine de l’utilisation des dispositifs d’assistance ventriculaire (DAV) percutanés en cas de ICP à risque élevé. Un support ventriculaire gauche permet de maintenir la perfusion coronarienne pendant les périodes d’hypotension passagère, lors de gonflements longs ou répétés, nécessaires pour parvenir à une revascularisation complète, » a-t-elle poursuivi.
L’étude Al-khadra et al. a été réalisée en toute indépendance par des praticiens-chercheurs, sans être financée ni évaluée par Abiomed. Les centres d’étude sont la clinique de Cleveland, le Detroit Medical Center, le Beth Israel Deaconess Medical Center/ Harvard Medical School, le MedStar Washington Hospital Center, le St. John Hospital and Medical Center, l’Université Emory, la Zucker School of Medicine au Hofstra Northwell Health, le Henry Ford Health System, l’Université Keele et le Royal Stoke University Hospital.
La pompe cardiaque Impella, fabriquée par Abiomed (NASDAQ: ABMD), est le dispositif d’assistance circulatoire mécanique le plus étudié de l’histoire de la FDA, avec plus de 14 années d’études de la FDA, des données cliniques réelles sur plus de 140 000 patients, et plus de 650 publications révisées par des pairs.
A PROPOS DES POMPES CARDIAQUES IMPELLA
Les pompes cardiaques Impella 2.5® et Impella CP® sont approuvées par l’AGP de la FDA américaine pour le traitement de certains patients atteints d’insuffisance cardiaque avancée subissant des interventions coronariennes percutanées urgentes de convenance (ICP) telles la pose d’un stent ou une angioplastie par ballonnet visant à élargir des artères coronaires bloquées. Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5™ avec Smart Assist® sont des pompes cardiaques approuvées par la FDA américaine pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie, en état de choc cardiogénique. Ces dispositifs ont la capacité unique de permettre la récupération du cœur natif, permettant ainsi aux patients de rentrer chez eux avec leur propre cœur. La pompe Impella RP® est approuvée par la FDA américaine pour le traitement de l’insuffisance ventriculaire droite ou la décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque ou une chirurgie à cœur ouvert. Impella est le dispositif d’assistance circulatoire mécanique le plus étudié de l’histoire de la FDA, avec plus de 10 années d’études de la FDA, de données cliniques réelles sur plus de 140 000 patients, et plus de 650 publications évaluées par des pairs.
En Europe, les dispositifs Impella 2.5, Impella CP et Impella CP avec SmartAssist sont certifiés CE pour le traitement des patients ICP à risque élevé et des patients AMI en choc cardiogène pendant un maximum de 5 jours. Les pompes Impella 5.0 et Impella LD sont certifiées CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en choc cardiogène pendant un maximum de 10 jours. La pompe Impella 5.5™ avec Smart Assist® est certifié CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en choc cardiogène pendant un maximum de 30 jours. La pompe Impella RP est certifiée CE pour le traitement de l’insuffisance ventriculaire droite ou la décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque, une chirurgie à cœur ouvert ou une arhytmie ventriculaire réfractaire.
Pour en savoir plus à propos de la plateforme de pompes cardiaques Impella, y compris leurs indications approuvées et les informations importantes en matière de sécurité et de risque, associées à l’utilisation de ces dispositifs, rendez-vous sur www.impella.com.
A PROPOS D’ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc. est un fournisseur de premier plan de dispositifs médicaux offrant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en effectuant le pompage du cœur. Pour plus d’informations, veuillez consulter www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP, et Impella Connect sont des marques déposées d’Abiomed, Inc., et sont enregistrées aux Etats-Unis et dans certains pays étrangers. Impella BTR, Impella 5.5, Impella ECP, CVAD Study et SmartAssist sont des marques commerciales d’Abiomed, Inc., en cours d’enregistrement.
DECLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement de produits existants et de nouveaux produits d’Abiomed, l’évolution de l’entreprise en matière de croissance commerciale, les occasions futures et les approbations réglementaires prévues. Les résultats réels de la société peuvent être sensiblement différents de ceux escomptés dans ces déclarations prospectives en raison d’un certain nombre de facteurs, notamment les incertitudes liées au développement, aux tests et aux approbations réglementaires connexes, comme le potentiel de pertes futures, une fabrication complexe, des exigences de qualité élevées, la dépendance à l’égard de sources d’approvisionnement limitées, la concurrence, les changements technologiques, la réglementation gouvernementale, les litiges, les besoins en capitaux dans le futur et l’incertitude quant à l’obtention de financements supplémentaires, ainsi que d’autres risques et difficultés détaillés dans les documents déposés par la société auprès de la Securities and Exchange Commission, notamment le dernier rapport annuel déposé sur le formulaire 10-K et le dernier rapport trimestriel déposé sur le formulaire 10-Q. Les lecteurs sont priés de ne pas se fier indûment aux déclarations prospectives, qui sont valables uniquement à la date du présent communiqué. La société n’est aucunement tenue de publier les résultats d’une quelconque révision de ces déclarations prospectives qui pourrait être faite afin de refléter des événements ou des circonstances survenant après la date de publication de ce communiqué ou pour refléter la survenue d’événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Tom Langford
Directeur de la Communication et des Relations publiques
978-882-8408
tlangford@abiomed.com